Pregled
Brza identifikacija transgenih biljaka
Tekst/Tong Yucheng
Eksperimentalna operacija/Han Ying
Urednik/Wen Youjun
Words/1600+
Preporučeno vrijeme čitanja/8-10 minuta
Brza identifikacija transgenih biljaka
Kao novajlija u laboratoriji, nije dobar posao izdvojiti pozitivne biljke iz gomile biljaka s niskom stopom konverzije.Prvo, DNK se mora izdvojiti iz velikog broja uzoraka jedan po jedan, a zatim će se strani geni otkriti PCR-om.Međutim, rezultati su često praznine i trake s nekoliko stavki povremeno, ali je nemoguće utvrditi da li postoje propuštene detekcije ili lažne detekcije..Je li vrlo bespomoćno suočiti se s takvim eksperimentalnim procesom i rezultatima?Ne brini, brat te uči kako lako i precizno izdvojiti transgene pozitivne biljke.
Korak 1: Dizajn prajmera za detekciju
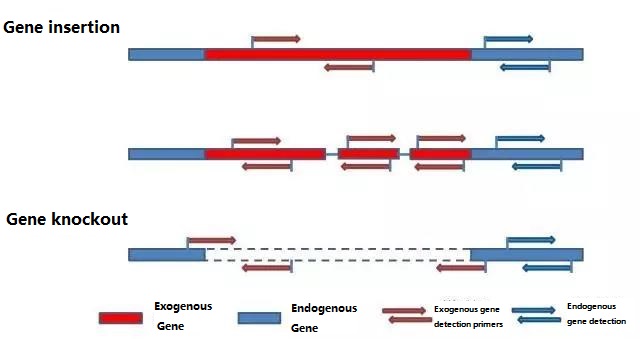
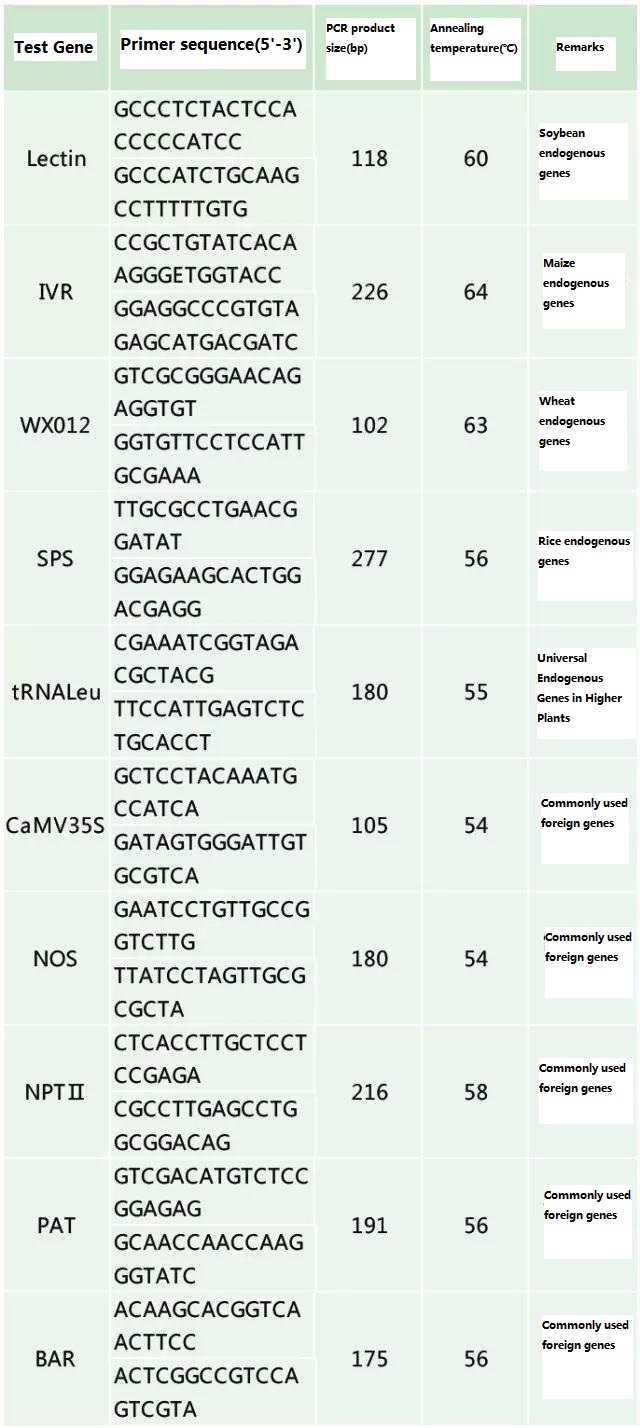
Odredite endogeni gen i egzogeni gen koji će se otkriti prema uzorku koji se testira i odaberite reprezentativnu sekvencu od 100-500 bp u genu za dizajn prajmera.Dobri prajmeri mogu osigurati tačnost rezultata detekcije i skratiti vrijeme detekcije (pogledajte dodatak za najčešće korištene prajmere za detekciju).
Bilješka:
Novo dizajnirani prajmeri treba da optimizuju reakcione uslove i provere tačnost, preciznost i granicu detekcije pre nego što izvedu detekciju velikih razmera.
2. korak:Razviti eksperimentalni protokol

Pozitivna kontrola: Koristite prečišćenu DNK koja sadrži ciljni fragment kao šablon da biste utvrdili da li su PCR reakcijski sistem i uslovi normalni.
Negativna/prazna kontrola: Koristite DNK šablon ili ddH2O koji ne sadrži ciljni fragment kao šablon za otkrivanje da li postoji izvor kontaminacije u PCR sistemu.
Unutrašnja referentna kontrola: koristite kombinaciju prajmera/sonde endogenog gena uzorka koji se testira da biste procenili da li se šablon može detektovati PCR-om.
Bilješka:
Pozitivne, negativne/prazne kontrole i interne kontrole treba postaviti za svaki test kako bi se procijenila valjanost eksperimentalnih rezultata.
Korak 3: Priprema eksperimenta

Prije upotrebe provjerite da li je otopina ravnomjerno izmiješana.Ako se nađe talog, potrebno ga je prije upotrebe otopiti i promiješati prema uputama.2×PCR mješavinu treba pipetirati i više puta miješati mikropipetom prije upotrebe kako bi se izbjegla neravnomjerna raspodjela jona.
Bilješka:
Izvadite upute i pažljivo ih pročitajte, a prije eksperimenta napravite pripreme strogo u skladu s uputama.
Korak 4: Pripremite PCR reakcijski sistem
Prema eksperimentalnom protokolu, pomiješajte prajmere, H2O, 2×PCR pomiješati, centrifugirati i distribuirati u svaku reakcijsku epruvetu.
Bilješka:
Za opsežna ili dugotrajna testiranja, preporučuje se upotreba PCR reakcijskog sistema koji sadrži UNG enzim, koji može efikasno izbjeći aerosolnu kontaminaciju uzrokovanu PCR proizvodima.
Korak 5: Dodajte šablon za reakciju

Koristeći Direct PCR tehnologiju, nema potrebe za zamornim procesom pročišćavanja nukleinskih kiselina.Šablon uzorka se može pripremiti u roku od 10 minuta i dodati u odgovarajući PCR reakcijski sistem.
Bilješka:
Metoda lize ima bolji efekat detekcije, a dobijeni proizvod se može koristiti za više reakcija detekcije.
5.1: Direktni PCR listova
Prema veličini slike u priručniku, izrežite tkivo lista prečnika 2-3 mm i stavite ga u PCR reakcijski sistem.
Napomena: Osigurajte da su fragmenti lista potpuno uronjeni u PCR reakcijsku otopinu i nemojte dodavati previše tkiva lista.
5.2: Metoda lize listova
Izrežite tkivo lista prečnika 5-7 mm i stavite ga u epruvetu za centrifugu.Ako odaberete zrelo lišće, izbjegavajte korištenje tkiva glavne žile lista.Odpipetirajte 50 ul lizata pufera P1 u epruvetu za centrifugiranje kako biste osigurali da lizat može u potpunosti uroniti tkivo lista, stavite ga u termocikler ili metalnu kupku i lizirajte na 95°C 5-10 minuta.


Dodajte 50 ul otopine za neutralizaciju pufera P2 i dobro promiješajte.Dobijeni lizat se može koristiti kao šablon i dodati u PCR reakcijski sistem.
Napomena: Količina šablona treba da bude između 5-10% PCR sistema i ne bi trebalo da prelazi 20% (na primer, u PCR sistemu od 20 μl, dodajte 1-2 μl pufera za lizu, ne više od 4 μl).
Korak 6: PCR reakcija

Nakon centrifugiranja PCR reakcijske epruvete, stavite ih u PCR instrument za amplifikaciju.
Bilješka:
Reakcija koristi nepročišćeni šablon za amplifikaciju, tako da je broj ciklusa amplifikacije 5-10 ciklusa veći nego kada se koristi pročišćeni DNK šablon.
Korak 7: Detekcija elektroforeze i analiza rezultata

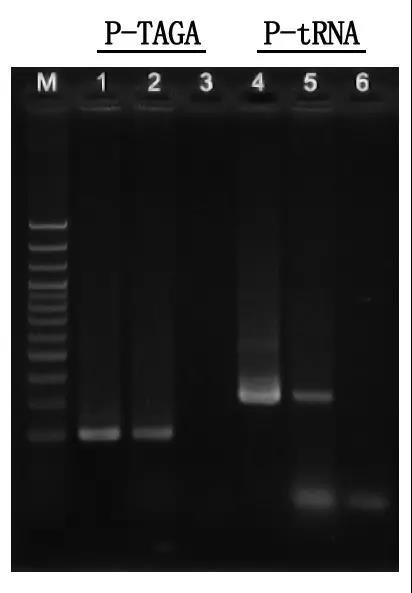
M: 100bp DNK Ladder
1\4: Metoda prečišćene DNK
2\5: Direktna PCR metoda
3\6: Prazna kontrola
Kontrola kvaliteta:
Rezultati testa različitih kontrola postavljenih u eksperimentu treba da ispunjavaju sledeće uslove.U suprotnom, potrebno je analizirati uzrok problema i ponoviti test nakon što se problem otkloni.
Tabela 1. Normalni rezultati ispitivanja različitih kontrolnih grupa

*Kada se plazmid koristi kao pozitivna kontrola, rezultat testa endogenog gena može biti negativan
Rezultat presude:
O. Rezultat testa endogenog gena uzorka je negativan, što ukazuje da se DNK pogodna za običnu PCR detekciju ne može izdvojiti iz uzorka ili ekstrahirana DNK sadrži inhibitore PCR reakcije i DNK treba ponovo ekstrahirati.
B. Rezultat testa endogenog gena uzorka je pozitivan, a egzogenog gena negativan, što ukazuje da je DNK pogodna za običnu PCR detekciju ekstrahirana iz uzorka, te se može ocijeniti da gen XXX nije detektovan u uzorku.
C. Rezultat testa endogenog gena uzorka je pozitivan, a rezultat testa egzogenog gena je pozitivan, što ukazuje da je DNK pogodna za običnu PCR detekciju ekstrahirana iz uzorka, a DNK uzorka sadrži XXX gen.Eksperimenti za potvrdu mogu se dalje provoditi.
Korak 8: Dizajnirajte prajmere za detekciju

Nakon eksperimenta, upotrijebite 2% otopinu natrijevog hipoklorita i 70% otopinu etanola da obrišete eksperimentalno područje kako biste spriječili zagađenje okoliša.
Dodatak
Tabela 2. Često korišteni prajmeri za opću PCR detekciju genetski modificiranih biljaka
Referentni dokument:
SN/T 1202-2010, Kvalitativna PCR metoda detekcije za genetski modificirane biljne sastojke u hrani.
Saopštenje Ministarstva poljoprivrede 1485-5-2010, Ispitivanje sastojaka genetski modifikovanih biljaka i njihovih proizvoda - pirinča M12 i njegovih derivata.
Vrijeme objave: Jun-09-2021








